
 ΔΕΙΤΕ ΠΡΩΤΟΙ ΟΛΑ ΤΑ ΝΕΑ ΤΟΥ TRIBUNE ΣΤΟ GOOGLE NEWS
ΔΕΙΤΕ ΠΡΩΤΟΙ ΟΛΑ ΤΑ ΝΕΑ ΤΟΥ TRIBUNE ΣΤΟ GOOGLE NEWS 
Διαβάστε σχετικά για Ηνωμένες Πολιτείες Αμερικής (ΗΠΑ), Κορωνοϊός - Κορονοϊός, Φάρμακα, Φαρμακοβιομηχανία,

















































 Μαρέβα Μητσοτάκη: Χειρουργήθηκε και στα δύο χέρια στο ΚΑΤ μετά από σοβαρό ατύχημα
Μαρέβα Μητσοτάκη: Χειρουργήθηκε και στα δύο χέρια στο ΚΑΤ μετά από σοβαρό ατύχημα  Συρία: Νέα επανάσταση ενάντια στο τζιχαντιστικό καθεστώς του Τζουλάνι - «Όχι στην Τουρκία»
Συρία: Νέα επανάσταση ενάντια στο τζιχαντιστικό καθεστώς του Τζουλάνι - «Όχι στην Τουρκία»  Καθαρισμοί οικοπέδων: Έρχονται μεγάλες αλλαγές με το νομοσχέδιο «Ενεργή Μάχη»
Καθαρισμοί οικοπέδων: Έρχονται μεγάλες αλλαγές με το νομοσχέδιο «Ενεργή Μάχη»  «Δουλίτσες» δισ. στη Συρία: Ο ένας αδελφός του τζιχαντιστή «προέδρου» Αλ-Σαράα είναι Ρώσος υπήκοος κι ο άλλος (πρώην) στέλεχος της
«Δουλίτσες» δισ. στη Συρία: Ο ένας αδελφός του τζιχαντιστή «προέδρου» Αλ-Σαράα είναι Ρώσος υπήκοος κι ο άλλος (πρώην) στέλεχος της  «Βροχή πυραύλων»: Νέα γιγαντοαφίσα στην Τεχεράνη απειλεί το Τελ Αβίβ με πυραυλικά πλήγματα
«Βροχή πυραύλων»: Νέα γιγαντοαφίσα στην Τεχεράνη απειλεί το Τελ Αβίβ με πυραυλικά πλήγματα 

 ΔΕΙΤΕ ΠΡΩΤΟΙ ΟΛΑ ΤΑ ΝΕΑ ΤΟΥ TRIBUNE ΣΤΟ GOOGLE NEWS
ΔΕΙΤΕ ΠΡΩΤΟΙ ΟΛΑ ΤΑ ΝΕΑ ΤΟΥ TRIBUNE ΣΤΟ GOOGLE NEWS 
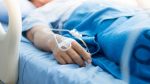
Αίτηση προς τον Αμερικανικό Οργανισμό Τροφίμων (FDA) για επείγουσα χορήγηση άδειας χρήσης χαπιού κατά του κορωνοϊού κατέθεσε η φαρμακοβιομηχανία Merck.
Εάν χορηγηθεί άδεια, το φάρμακο, που κατασκευάστηκε από την Merck and Ridgeback Biotherapeutics, θα είναι η πρώτη αντιική θεραπεία σε μορφή χαπιού για την καταπολέμηση της Covid-19.
Η απόφαση του FDA θα μπορούσε να ληφθεί μέσα στις επόμενες εβδομάδες.
Η Merck διευκρίνισε ότι η αγωγή τη θεραπεία προσβεβλημένων ενηλίκων που διατρέχουν τον κίνδυνο να νοσήσουν σοβαρά με Covid-19 ή να νοσηλευτούν.
Το αίτημα της εταιρείας βασίζεται σε μελέτη η οποία σταμάτησε σε ενδιάμεσο στάδιο επειδή το φάρμακο με τη δραστική ουσία μολνουπιραβίρη (molnupiravir) λειτούργησε πολύ καλά στους ασθενείς.
«Η μολνουπιραβίρη μείωσε τον κίνδυνο νοσηλείας ή θανάτου κατά περίπου 50%.
»Το 7,3% των ασθενών που έλαβαν molnupiravir είτε νοσηλεύτηκαν είτε πέθαναν μέχρι την 29η ημέρα μετά από τυχαιοποίηση, σε σύγκριση με το 14,1% των ασθενών που έλαβαν εικονικό φάρμακο», ανέφερε η εταιρεία.
«Μέχρι την 29η ημέρα, δεν αναφέρθηκαν θάνατοι σε ασθενείς που έλαβαν μολνουπιραβίρη, σε σύγκριση με οκτώ θανάτους σε ασθενείς που έλαβαν εικονικό φάρμακο».
Κανένας από τους εθελοντές της δοκιμής δεν είχε εμβολιαστεί.
«Οι επιπτώσεις αυτής της πανδημίας απαιτούν να κινηθούμε με την ανάγκη του κατεπείγοντος και αυτό έκαναν οι ομάδες μας υποβάλλοντας αυτήν την αίτηση για το molnupiravir στον FDA μέσα σε 10 ημέρες από τη λήψη των δεδομένων», δήλωσε ο CEO της Merck και πρόεδρος Ρόμπερτ Ντέιβις.
Τα δεδομένα από τη δοκιμή δεν έχουν ακόμη αξιολογηθεί ή δημοσιευθεί.





























































